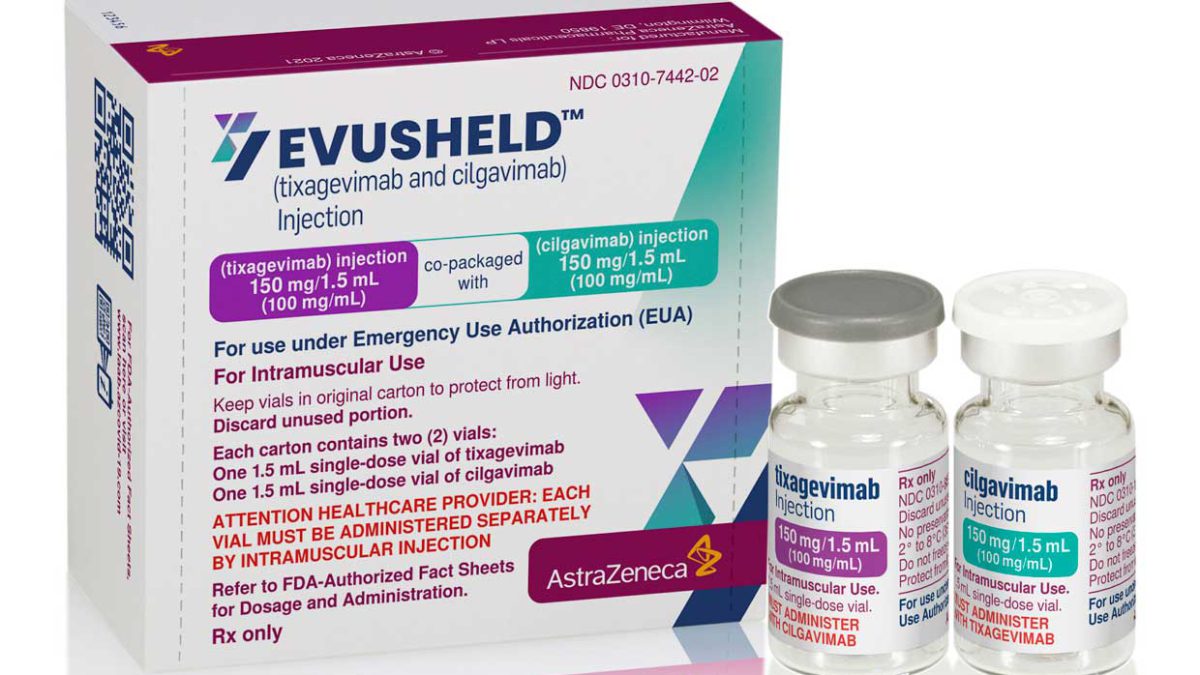
Las autoridades sanitarias federales autorizaron el miércoles un nuevo medicamento de anticuerpos contra el COVID-19 para las personas con problemas de salud graves o alergias que no pueden obtener una protección adecuada con la vacunación.
Los medicamentos de anticuerpos han sido un tratamiento estándar para tratar las infecciones por COVID-19 durante más de un año. Pero el fármaco de anticuerpos de AstraZeneca autorizado por la Administración de Alimentos y Medicamentos es diferente. Es el primero destinado a la prevención a largo plazo de la infección por COVID-19, más que al tratamiento a corto plazo.
Entre las personas que podrían beneficiarse de este anticuerpo se encuentran los pacientes con cáncer, los receptores de trasplantes de órganos y las personas que toman medicamentos inmunosupresores para enfermedades como la artritis reumatoide. Los expertos en salud calculan que entre el 2% y el 3% de la población estadounidense pertenece a este grupo.
“Estas personas todavía tienen que refugiarse en su lugar porque corren un riesgo realmente alto de padecer enfermedades graves y morir”, dijo el Dr. David Boulware, de la Universidad de Minnesota, antes del anuncio. “Así que tener esta terapia permitirá a muchos de ellos volver a su vida normal”.
En concreto, la FDA autorizó el fármaco de AstraZeneca denominado Evusheld para adultos y niños mayores de 12 años cuyo sistema inmunitario no haya respondido adecuadamente a las vacunas COVID-19 o que tengan antecedentes de reacciones alérgicas graves a las inyecciones. Los reguladores dijeron que las dos inyecciones de anticuerpos requeridas pueden ser eficaces para prevenir las infecciones por COVID-19 durante seis meses.
Al igual que otros fármacos similares, el de AstraZeneca suministra versiones de laboratorio de las proteínas de los anticuerpos humanos, que ayudan al sistema inmunitario a combatir los virus y otras infecciones.
Evusheld combina dos tipos de anticuerpos sintéticos (tixagevimab y cilgavimab), y se administra en dos inyecciones intramusculares, una inmediatamente después de la otra. Estos anticuerpos ayudan al sistema inmunitario a combatir el virus dirigiéndose a su proteína de espiga, que le permite entrar en las células e infectarlas.
La FDA dijo que el tratamiento “puede ser eficaz para la prevención previa a la exposición durante seis meses”.
No puede administrarse a alguien que ya esté infectado por el virus, dijo la FDA, aunque AstraZeneca lo está probando para ese tratamiento.
Los efectos secundarios pueden incluir una reacción alérgica, sangrado en el lugar de la inyección, dolor de cabeza y fatiga.
La autorización de la FDA se basó en un ensayo clínico realizado en personas mayores de 59 años no vacunadas, o con una enfermedad crónica, o con alto riesgo de infección.
El fármaco se administró a 3.500 personas, mientras que 1.700 recibieron un placebo. El ensayo demostró que el tratamiento reducía el riesgo de desarrollar Covid-19 en un 77%.
La FDA y otras autoridades sanitarias han subrayado que los fármacos con anticuerpos no sustituyen a las vacunas, que ofrecen la forma más eficaz, duradera y económica de protección contra el virus. Los fármacos de anticuerpos son difíciles de fabricar y suelen costar más de 1.000 dólares por dosis, en comparación con las vacunas, que suelen costar menos de 30 dólares por inyección.
La FDA ha autorizado otras tres terapias de anticuerpos de Regeneron, Eli Lilly y GlaxoSmithKline, y el gobierno estadounidense ha comprado cientos de miles de dosis. Todas ellas requieren una vía intravenosa o una inyección. Se utilizan para tratar a personas con infecciones recientes que tienen el mayor riesgo de evolucionar a una COVID-19 grave debido a otros problemas de salud. Dos pueden utilizarse para prevenir la infección tras una posible exposición al coronavirus.
El fármaco de AstraZeneca se utilizaría de forma diferente: sólo como medida preventiva a largo plazo en personas que tienen una mayor vulnerabilidad al virus.
En un estudio de la empresa, las personas que recibieron Evusheld tuvieron un riesgo de infección un 77% menor que las que recibieron una inyección ficticia durante seis meses, según la FDA.