Actualmente se están desarrollando robots nadadores microscópicos que podrían navegar por el cuerpo para realizar tareas médicas como la administración de terapias oncológicas específicas o cirugías. En un estudio publicado el 24 de marzo en Science Robotics, los científicos fabricaron microrobots controlados magnéticamente a partir de neutrófilos, un tipo de glóbulo blanco. En ratones, estos llamados neutrobots penetraron la barrera hematoencefálica (BBB) para administrar fármacos a las células cancerosas del cerebro.
“Se trata de una idea muy interesante”, afirma Liangfang Zhang, nanoingeniero y bioingeniero de la Universidad de California en San Diego, que no participó en el estudio. “Yo diría que este trabajo es todavía un estudio de prueba de concepto, pero creo que el concepto general es novedoso. Es interesante porque es una nueva forma de pensar sobre cómo enviar carga al cerebro”.
Uno de los principales obstáculos en el tratamiento de las enfermedades neurológicas es conseguir que los fármacos pasen la BBB, una frontera muy selectiva que niega la admisión de la mayoría de las sustancias al cerebro. Sin embargo, algunos glóbulos blancos tienen un acceso especial para tratar las infecciones y la inflamación, lo que los convierte en buenos caballos de Troya para hacer pasar los fármacos por este bloqueo. En estudios anteriores, los científicos han cargado fármacos contra el cáncer cerebral en neutrófilos y macrófagos, que tienen una capacidad natural para buscar el cáncer porque nadan hacia concentraciones más altas de sustancias químicas inflamatorias liberadas por el tejido enfermo.
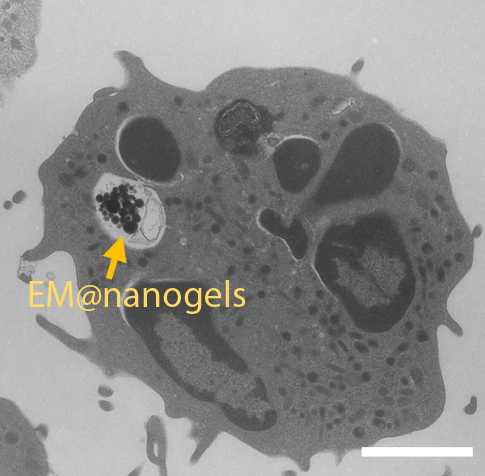
H. ZHANG ET AL. CIENCIA ROBÓTICA, 2021
Pero las iteraciones anteriores de células inmunitarias que transportan fármacos no han logrado tratar completamente los tumores cerebrales de los ratones, probablemente debido en parte a la lentitud de la migración al lugar de la enfermedad. Para mejorar la velocidad y el control, los científicos han dotado a los microrobots basados en espermatozoides, bacterias o glóbulos rojos de material magnético para guiarlos externamente con campos magnéticos, explica Zhiguang Wu, bioingeniero del Instituto de Tecnología de Harbin (China) y coautor del nuevo estudio.
Para tratar el glioma, un tipo de cáncer cerebral, en ratones, Wu y sus colegas diseñaron microrrobots basados en neutrófilos -neutralizadores- que podían controlarse con un campo magnético. En primer lugar, el equipo fabricó nanopartículas a partir de un gel incrustado con perlas de óxido de hierro magnético y el fármaco oncológico paclitaxel, ampliamente utilizado. A continuación, las nanopartículas se envolvieron en la membrana de la bacteria E. coli. Disfrazadas de bacterias nocivas, las nanopartículas fueron engullidas por neutrófilos de ratón in vitro mucho más fácilmente que las nanopartículas desnudas. Los científicos descubrieron que la capa bacteriana también impedía la fuga prematura de fármacos y hacía que las partículas fueran menos tóxicas para los neutrófilos.
El equipo probó la capacidad de navegación y administración de fármacos de los neutrófilos in vitro. Bajo el control de un campo magnético giratorio, los neutrófilos alcanzaron una velocidad de 16,4 µm por segundo, unas 50 veces más rápida que la de los neutrófilos naturales. Al controlar los neutrófilos mediante un microscopio, los científicos pudieron dirigirlos para que se movieran en orientaciones complejas sobre un sustrato artificial.
Para evaluar la capacidad de los neutrófilos de buscar la inflamación, los científicos los colocaron en un gel con un gradiente de concentración de un factor inflamatorio. Los neutrófilos migraron hacia concentraciones más altas de la sustancia química a una velocidad similar a la de los neutrófilos naturales. Y en un modelo de BBB, los neutrófilos penetraron en las células de ratón cultivadas en una membrana para acceder a las células de glioma y liberaron su carga farmacológica al exponerse a las señales de inflamación.
Por último, los científicos comprobaron si los robots podían tratar el cáncer cerebral en ratones. En primer lugar, inyectaron células de glioma en el cerebro de los ratones. Al cabo de 10 días, operaron a algunos de los ratones para extirparles una parte del tumor con el fin de potenciar las señales inflamatorias que atraen a los neutrófilos. Los científicos inyectaron neutrófilos en la cola de todos los ratones y, en un subconjunto de ellos, utilizaron un campo magnético giratorio para dirigir los neutrófilos hacia el cerebro. Mediante resonancia magnética (RM), el equipo descubrió que se acumulaban más neutrófilos alrededor de los gliomas en los ratones tratados tanto con cirugía como con el campo magnético, en comparación con los ratones que no fueron expuestos al campo magnético, no se sometieron a cirugía o no recibieron ninguno de los dos. Los ratones tratados doblemente también sobrevivieron más tiempo, lo que demuestra que las dos intervenciones se complementaron. La microscopía electrónica de transmisión confirmó que los neutrófilos penetraron en la BBB y entraron en el tejido del glioma.
Todos los ratones tratados con neutrobots sobrevivieron más tiempo en comparación con los animales tratados solo con una inyección de solución salina o de paclitaxel, lo que indica que los neutrobots podían seguir suministrando fármacos a través de la BBB en respuesta a una señal inflamatoria débil o a una señal inflamatoria fuerte sin propulsión magnética.
Según Zhang, los componentes individuales del estudio -el uso de células inmunitarias como portadoras de fármacos, las nanopartículas controladas magnéticamente y las membranas bacterianas como capas- no son nuevos. “Pero lo que hicieron fue integrar estos componentes individuales comunes y ensamblarlos en un nuevo sistema”, afirma. “Desarrollaron una funcionalidad muy singular: el control de largo alcance de los neutrófilos”.
¿Robots contra el cáncer en la clínica?
Mariana Medina-Sánchez, bioingeniera del Instituto Leibniz de Investigación del Estado Sólido y los Materiales de Dresde (Alemania), que no ha participado en la investigación, afirma que el estudio es valioso porque demuestra la eficacia del tratamiento de los tumores in vivo, un objetivo de muchos científicos en este campo. “[El estudio] es completo, es sistemático y hay pruebas sólidas de que lo que han desarrollado funciona”, afirma.
Pero antes de que los microrobots puedan utilizarse para tratar el cáncer en las personas, todavía hay que superar una serie de retos. Uno de ellos es mejorar el porcentaje de microrobots que llegan al tumor. “Tenían una acumulación de estos microrobots basados en neutrófilos de alrededor del once por ciento en el lugar de la enfermedad [in vivo]. ¿Y qué pasa con los demás?”, dice Medina-Sánchez. Los microrobots podrían acumularse en otros órganos o regiones del cuerpo, y se desconocen los efectos secundarios a largo plazo, dice. “Pero esto ocurre con cualquier tipo de microrobot, no solo con este trabajo en particular. Es un reto para todos [que hay que superar]”.
Una vez que los microrobots llegan al lugar de la enfermedad, otro obstáculo es asegurarse de que administran suficiente cantidad de fármaco. “Hay que aumentar la carga total del fármaco en su interior, y también hay que controlar la liberación prematura del mismo”, dice Zhang. “Los neutrófilos tardan en llegar a su destino. No se quiere que viertan toda la carga útil antes de llegar al destino”.
Dado que un solo microrobot no puede transportar suficiente medicación para tratar una enfermedad, los científic ostambién intentan comprender cómo se mueven en forma de enjambre, de forma similar a los movimientos colectivos de grupos de hormigas, peces o aves. “Si se conoce la cantidad de fármaco que se carga por microrrobot, se puede controlar la dosis de fármaco mediante la formación de enjambres de estos microrrobots de forma controlada”, dice Medina-Sánchez. “Así que éste es uno de los retos: cómo transportar múltiples [microrobots] de forma controlada y llevarlos a un lugar determinado”. Wu y sus colegas descubrieron que los neutrófilos formaban cadenas de cuatro in vitro, y que estos enjambres nadaban unas cinco veces más rápido que los robots individuales. Pero según Medina-Sánchez, otros científicos de microrobots aspiran a formar enjambres de cientos, miles o incluso millones. “Depende del objetivo y de la ubicación”, dice. “Puedes necesitar solo unos pocos o millones de ellos”.
No está claro cómo se agrupan los neutrófilos en los ratones porque las técnicas de imagen actuales no son lo suficientemente buenas como para rastrear en tiempo real cadenas individuales o pequeñas de microrrobots con una resolución lo suficientemente alta in vivo, lo que supone otro reto para la navegación precisa de estos diminutos mensajeros de drogas en humanos.