Evitando la inyección de un óvulo con esperma, los genetistas del Instituto Weizmann de Ciencias han logrado un gran avance: crear embriones sintéticos de ratón con corazones y cerebros que laten fuera del útero utilizando células madre extraídas de la piel y cultivadas en una placa.
“El embrión es la mejor máquina de fabricar órganos y la mejor bioimpresora en 3D; hemos intentado emular lo que hace”, señaló el jefe del equipo de investigación, el profesor Jacob Hanna, del Departamento de Genética Molecular del instituto de Rehovot.
Los científicos ya saben cómo devolver a las células maduras su condición de “madre”: los pioneros de esta reprogramación celular ganaron el Premio Nobel en 2012. Pero ir en la dirección contraria, es decir, hacer que las células madre se diferencien en células corporales especializadas, por no decir que formen órganos enteros, ha resultado mucho más problemático.
¿Por qué es más problemático?
“Hasta ahora, en la mayoría de los estudios, las células especializadas solían ser difíciles de producir o aberrantes, y tendían a formar un batiburrillo en lugar de un tejido bien estructurado apto para el trasplante. Conseguimos superar estos obstáculos liberando el potencial de autoorganización codificado en las células madre”.

El avance acaba de publicarse en la revista Cell con el título “Embriones sintéticos postgástricos generados ex utero a partir de CMEs nativas de ratón”.
El encuentro de un óvulo con un espermatozoide ha sido el primer paso necesario en los inicios de la vida, y también es un primer paso habitual en la investigación del desarrollo embrionario. Pero el equipo de Hanna lo ha hecho sin utilizar óvulos fecundados.
¿Qué significa esto para el futuro?
El método abre nuevos horizontes para estudiar cómo las células madre forman diversos órganos en el embrión en desarrollo y puede que algún día permita cultivar tejidos y órganos para trasplantes utilizando modelos de embriones sintéticos.
El equipo de Hanna se basó en dos avances anteriores de su laboratorio. Uno de ellos era un método eficaz para reprogramar las células madre a un estado ingenuo -es decir, a su etapa más temprana-, cuando tienen el mayor potencial para especializarse en diferentes tipos de células.
El otro, descrito en un artículo científico en Nature en marzo de 2021, era el dispositivo controlado electrónicamente que el equipo había desarrollado a lo largo de siete años de ensayo y error para cultivar embriones naturales de ratón fuera del útero.
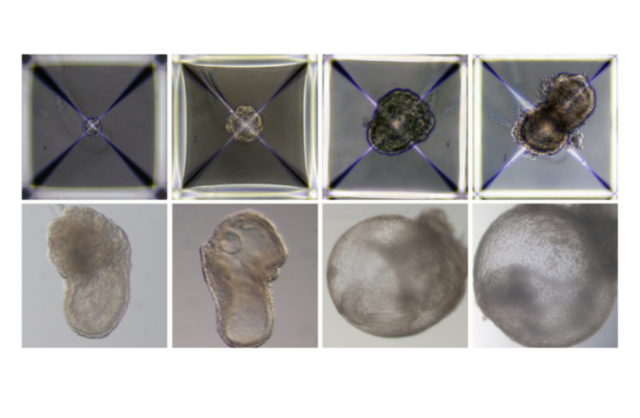
El dispositivo mantiene a los embriones bañados en una solución nutritiva dentro de unos vasos que se mueven continuamente, simulando el modo en que los nutrientes son suministrados por el flujo sanguíneo material a la placenta, y controla estrechamente el intercambio de oxígeno y la presión atmosférica.
En la investigación anterior, el equipo había utilizado con éxito este dispositivo para cultivar embriones naturales de ratón desde el quinto al undécimo día.
En el nuevo estudio, el equipo se propuso cultivar un modelo de embrión sintético únicamente a partir de células madre de ratón ingenuas que habían sido cultivadas durante años en una placa de Petri, sin partir de un óvulo fecundado.
Este enfoque es muy valioso porque podría obviar en gran medida los problemas técnicos y éticos que conlleva el uso de embriones naturales en la investigación y la biotecnología.
Incluso en el caso de los ratones, ciertos experimentos son actualmente inviables porque requerirían miles de embriones, mientras que el acceso a modelos derivados de células embrionarias de ratón, que crecen en incubadoras de laboratorio por millones, es prácticamente ilimitado.
Antes de colocar las células madre en el dispositivo, los investigadores las separaron en tres grupos. En uno de ellos, que contenía células destinadas a convertirse en órganos embrionarios propiamente dichos, las células se dejaron tal cual.
Las células de los otros dos grupos fueron pretratadas durante sólo 48 horas para sobreexpresar uno de los dos tipos de genes, reguladores maestros de la placenta o del saco vitelino. “Dimos a estos dos grupos de células un impulso transitorio para que dieran lugar a tejidos extraembrionarios que sostuvieran al embrión en desarrollo”, explicó Hanna.
Poco después de mezclarse en el interior del dispositivo, los tres grupos de células se reunieron en agregados, la gran mayoría de los cuales no se desarrollaron adecuadamente. Sin embargo, 50 de unas 10.000 células formaron esferas, cada una de las cuales se convirtió en una estructura alargada similar a un embrión.
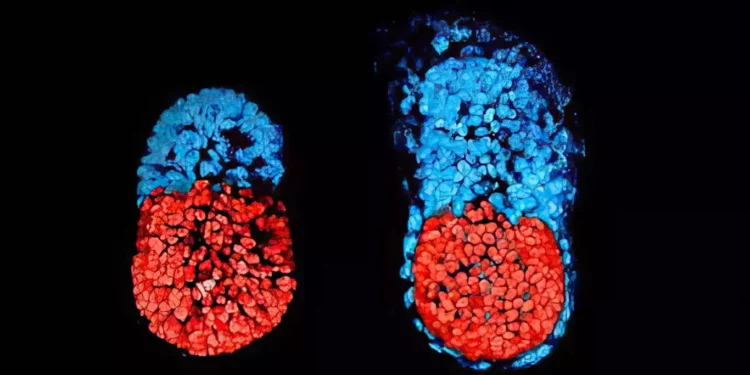
Como los investigadores habían etiquetado cada grupo de células con un color diferente, pudieron observar la formación de la placenta y los sacos vitelinos fuera de los embriones y el desarrollo del modelo como en un embrión natural.
Los modelos sintéticos se desarrollaron con normalidad hasta el día 8,5 -casi la mitad de los 20 días de gestación del ratón-, momento en el que se habían formado todos los progenitores de órganos tempranos, incluido un corazón que late, la circulación de células madre sanguíneas y un cerebro con pliegues bien formados, un tubo neural y un tracto intestinal.
Cuando se compararon con embriones naturales de ratón, los modelos sintéticos mostraron un 95% de similitud tanto en la forma de las estructuras internas como en los patrones de expresión génica de los distintos tipos de células. Los órganos observados en los modelos daban todos los indicios de ser funcionales.
Para Hanna y otros investigadores de células madre y desarrollo embrionario, el estudio presenta una nueva plataforma. “Nuestro próximo reto es entender cómo las células madre saben qué hacer: cómo se autoconforman en órganos y encuentran el camino hacia sus lugares asignados dentro de un embrión”.
“Y como nuestro sistema, a diferencia de un útero, es transparente, puede resultar útil para modelar los defectos de nacimiento e implantación de los embriones humanos”.
Los modelos de embriones sintéticos no sólo minimizarán el uso de animales en la investigación, sino que también podrían llegar a ser una fuente fiable de células, tejidos y órganos para trasplantes.
“En lugar de desarrollar un protocolo diferente para cultivar cada tipo de célula -por ejemplo, las del riñón o el hígado-, es posible que algún día podamos crear un modelo sintético similar al de un embrión y luego aislar las células que necesitamos. No tendremos que dictar a los órganos emergentes cómo deben desarrollarse. El propio embrión es el que mejor lo hace”.